Objetivo: Que el alumno aplique el concepto de calor.
El calor es la transferencia de energía entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas.El calor es energía en transito,siempre fluye de una temperatura a una zona menor de temperatura,con lo que eleva la temperatura de la segunda y reduce la de la primera, siempre que el volumen de los cuerpos se mantenga constante.
"INTRODUCCIÓN"
 |
El calor es la transferencia de energía entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas.El calor es energía en transito,siempre fluye de una temperatura a una zona menor de temperatura,con lo que eleva la temperatura de la segunda y reduce la de la primera, siempre que el volumen de los cuerpos se mantenga constante.
"MARCO TEÓRICO"
Unidades de medida del calor
Un joule (J) es w=1Nx1m=(Kg)(m/s2xm)=(1Kg)(m2/s2)
Caloría (cal) Es la cantidad de calor necesaria para elevar la temperatura de un gramo de agua de 14.5°C a 15.5°C, en mediciones normales.
Kilocaloria(Kcal) es la cantidad d calor necesaria para elevar la temperatura de un kilogramo de agua a un grado Celsius. (Kcal)= 1000(cal).
Unidad Térmica Británica (BTU) es la cantidad de calor necesaria para elevar en un grado Fahrenheit una libra de agua que equivale a 252(cal).
Materia
ENERGÍA
Ley de la Conservación de la Energía
"DESARROLLO"

CALORÍAS QUE SE QUEMAN
MARIBEL: 1600 calorías Calorías que ingiero al día=1600(cal)
Calorías que quemo al día=622(cal)
RUBÍ: 1641 calorías Calorías que ingiero al día=1641(cal)
Materia
Materia es todo aquello que ocupa un lugar en el espacio, tiene una energía medible y está sujeto a cambios en el tiempo y a interacciones con aparatos de medida. Se considera que es lo que forma la parte sensible de los objetos perceptibles o detectables por medios físicos. Es decir es todo aquello que ocupa un sitio en el espacio, se puede tocar, se puede sentir, se puede medir, etc.
ENERGÍA
El término energía tiene diversas acepciones y definiciones, relacionadas con la idea de una capacidad para obrar, transformar o poner en movimiento.
En física, energía se define como la capacidad para realizar un trabajo.

La energía es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza.
La energía se manifiesta en los cambios físicos, por ejemplo, al elevar un objeto, transportarlo, deformarlo o calentarlo.
La energía está presente también en los cambios químicos, como al quemar un trozo de madera o en la descomposición de agua mediante la corriente eléctrica.
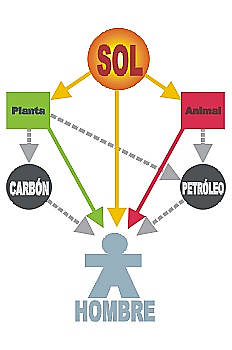
Ley de la Conservación de la Energía
La ley de la conservación de la energía constituye el primer principio de la termodinámica y afirma que la cantidad total de energía en cualquier sistema aislado (sin interacción con ningún otro sistema) permanece invariable con el tiempo, aunque dicha energía puede transformarse en otra forma de energía.
Esta ley es una de las leyes fundamentales de la física y su teoría se trata de que la energía no se crea ni se destruye, únicamente se transforma (ello implica que la masa en ciertas condiciones se puede considerar como una forma de energía .En general , no se tratará aquí el problema de conservación de masa en energía ya que se incluye la teoría de la relatividad ).
La ley de conservación de la energía afirma que:
1.-No existe ni puede existir nada capaz de generar energía .
2.-No existe ni puede existir nada capaz de hacer desaparecer la energía.
3.-Si se observa que la cantidad de energía varía siempre será posible atribuir dicha variación a un intercambio de energía con algún otro cuerpo o con el medio circundante.
"DESARROLLO"

CALORÍAS QUE NECESITAMOS EN UN DÍA
Las calorías que necesitamos cada día para mantener nuestro cuerpo en forma y poder realizar las actividades de la vida diaria, dependen de muchos factores, entre ellos, el sexo, la edad, el clima del lugar dónde vivimos, la alimentación que llevamos y el gasto de energía producido por la actividad física.
Las calorías que gastamos con el ejercicio físico suele ser muy variable, pero puede representar entre un 15 y un 30 por ciento del gasto energético total. Sin embargo, en deportistas, que son individuos muy activos, el gasto puede superar los valores promedios y significar un 50% del total de energía consumida.
El requerimiento energético de una persona adulta sana es de aproximadamente 28 a 32 calorías por kilogramo de peso por día. Por ejemplo: persona de 70 kilos, 28 x 70= 1960; 32 x 70= 2240. Esta persona necesita entre 1960 y 2240 calorías por día para mantenerse en su peso corporal.
Si el peso del individuo es mayor y padece de obesidad, las calorías deben calcularse con un valor fijo menor o estimarse a partir del peso que debería tener esa persona para tener un estado de salud normal.
Ahora bien, debido a que el gasto por actividad física es fundamental para el cálculo energético, veamos cuántas calorías se queman según el ejercicio o deporte que realicemos y la intensidad del mismo:
Actividad ligera: caminar, pescar, golf, bolos. Se queman entre 1,5 y 4,9 calorías por minuto.
Actividad moderada: Baile, voleibol, ciclismo de placer. Se gastan entre 3,5 y 7,4 calorías por minuto.
Actividad intensa: patinaje no sobre hielo, esquí acuático, tenis, trote. Con estas actividades podes quemar entre 5,5 y 9,9 calorías por minuto.
Actividad muy intensa: Esgrima, futbol, basquet, natación. Se gastan entre 7,5 y 12,4 calorías por minuto.
Actividad extremadamente intensa: Squash, correr. Se queman más de 10 calorías por minuto.Efecto de la dieta que tu sirva para conseguir antes y más fácilmente tu objetivo. El rendimiento deportivo óptimo depende, por una parte, del mantenimiento del peso.
Actividad Realizada Gasto por minuto Gasto por Hora
Pasar la aspiradora 3.8 114
Lavar platos 2.6 78
Barrer 2.2 66
Fregar el suelo 2.5 75
Hacer la cama 3 90
Lavar ropa 2.7 81
Planchar 3.1 93
Cocinar 2.4 72
Limpiar ventanas 4 120
Ver TV 0.5 15
Conducir 2 60
Caminar a 3,5 km /hora 3 90
Caminar a 5 km /hora 4 120
Bajar escaleras 6.8 204
Subir escaleras 17.5 525
Bailar 4 120
SANDRA: 1624 calorías Calorías que ingiero al día=1624(cal)
Calorías que quemo al día=573(cal)
MARIBEL: 1600 calorías Calorías que ingiero al día=1600(cal)
Calorías que quemo al día=622(cal)
RUBÍ: 1641 calorías Calorías que ingiero al día=1641(cal)
Calorías que quemo al día=678(cal)

















